Хирургическая профилактика ишемических инсультов
 Проблема сосудистых заболеваний мозга имеет исключительную медицинскую и социальную значимость.
Проблема сосудистых заболеваний мозга имеет исключительную медицинскую и социальную значимость.
По экспертным оценкам Всемирной организации здравоохранения (ВОЗ), инсульт занимает второе место в мире среди причин смертности. Так, в 2015 году показатель смертности от инсульта составил более 6 миллионов человек. По данным Федеральной службы государственной статистики Российской Федерации, ЦВЗ занимают второе место в структуре смертности от сердечно-сосудистых заболеваний (39%), доля ОНМК в структуре общей смертности населения составляет 21,4%. В острый период инсульта летальность достигает 35% и к первому году с момента развития заболевания умирают 50% больных.
 С 2008 по 2016 г. смертность от инсульта в Российской Федерации снизилась на 45% и составила 123 случая на 100 тыс. населения. Наиболее вероятным исходом ишемического инсульта, кроме летального, является инвалидизация населения, достигающая 80%. И только у 11-13% больных, перенесших инсульт, наблюдается полный регресс неврологической симптоматики (З.А. Суслина, Ю.Я. Варакин. Эпидемиологические аспекты изучения инсульта. Время подводить итоги. Анналы клинической и экспериментальной неврологии, 2007 г., т.1, №2, с. 12-13). На сегодняшний день в России создана современная служба экстренной специализированной медицинской помощи, в которую входят более 590 сосудистых центров, где применяются современные технологии диагностики и лечения.
С 2008 по 2016 г. смертность от инсульта в Российской Федерации снизилась на 45% и составила 123 случая на 100 тыс. населения. Наиболее вероятным исходом ишемического инсульта, кроме летального, является инвалидизация населения, достигающая 80%. И только у 11-13% больных, перенесших инсульт, наблюдается полный регресс неврологической симптоматики (З.А. Суслина, Ю.Я. Варакин. Эпидемиологические аспекты изучения инсульта. Время подводить итоги. Анналы клинической и экспериментальной неврологии, 2007 г., т.1, №2, с. 12-13). На сегодняшний день в России создана современная служба экстренной специализированной медицинской помощи, в которую входят более 590 сосудистых центров, где применяются современные технологии диагностики и лечения.
 Кроме того, цереброваскулярные заболевания наносят огромный экономический ущерб. К примеру, непосредственный экономический ущерб от инсульта и его последствий в мире за 2004 год составил 53,6 млрд. долларов США (SvetlikovA., 2005). По данным экспертов ВОЗ, расходы на лечение и реабилитацию одного больного с инсультом должны составлять 55-73 тыс. долларов в год. Исходя из этих расчетов, общие затраты на лечение больных с инсультом в России должны составлять 16,5-22 млрд. долл. США в год. Много ли это? К примеру, бюджет всего российского здравоохранения в 2005 году составил всего 650 млрд. рублей или 26 млрд. долларов США. В абсолютных цифрах расходы здравоохранения на душу населения в РФ в 40 раз ниже, чем в США, в 20-30 раз – чем в Западной Европе, в 6,5 раза – чем в Чехии и в 1,9 раза – чем в Турции (Р.С. Акчурин, Г.Э. Улумбекова Недофинансированное здравоохранение – удел слаборазвитого государства, ООО «Комплексный Медицинский Консалтинг». Издательская группа «ГЭОТАР-Медиа»).
Кроме того, цереброваскулярные заболевания наносят огромный экономический ущерб. К примеру, непосредственный экономический ущерб от инсульта и его последствий в мире за 2004 год составил 53,6 млрд. долларов США (SvetlikovA., 2005). По данным экспертов ВОЗ, расходы на лечение и реабилитацию одного больного с инсультом должны составлять 55-73 тыс. долларов в год. Исходя из этих расчетов, общие затраты на лечение больных с инсультом в России должны составлять 16,5-22 млрд. долл. США в год. Много ли это? К примеру, бюджет всего российского здравоохранения в 2005 году составил всего 650 млрд. рублей или 26 млрд. долларов США. В абсолютных цифрах расходы здравоохранения на душу населения в РФ в 40 раз ниже, чем в США, в 20-30 раз – чем в Западной Европе, в 6,5 раза – чем в Чехии и в 1,9 раза – чем в Турции (Р.С. Акчурин, Г.Э. Улумбекова Недофинансированное здравоохранение – удел слаборазвитого государства, ООО «Комплексный Медицинский Консалтинг». Издательская группа «ГЭОТАР-Медиа»).
Инсульт – клинический синдром, представленный очаговыми неврологическими и общемозговыми нарушениями, развивающимися внезапно вследствие острого нарушения мозгового кровообращения и сохраняющимися не менее 24 часов (или заканчивающиеся смертью больного). Острое нарушение мозгового кровообращения (ОНМК) – понятие, включающее не только инсульт, но и преходящие нарушения мозгового кровообращения (по отечественной классификации 1985 года) или транзиторные ишемические атаки (по классификации ВОЗ 1978 года), а также малый инсульт, при котором восстановление нарушенных функций происходит в сроки до 3 недель. Риск развития повторных нарушений мозгового кровообращения после первично перенесенного инсульта оценивается в 27-30% в течение первого года и в 50% – в последующие 5 лет. В общей структуре нарушений мозгового кровообращения (НМК) ишемические инсульты (ИИ) составляют около 80% (З.А. Суслина, М.А. Пирадов. Инсульт: диагностика, лечение, профилактика. Руководство для врачей, Москва, МЕДпресс-информ, 2008, с. 12-13).
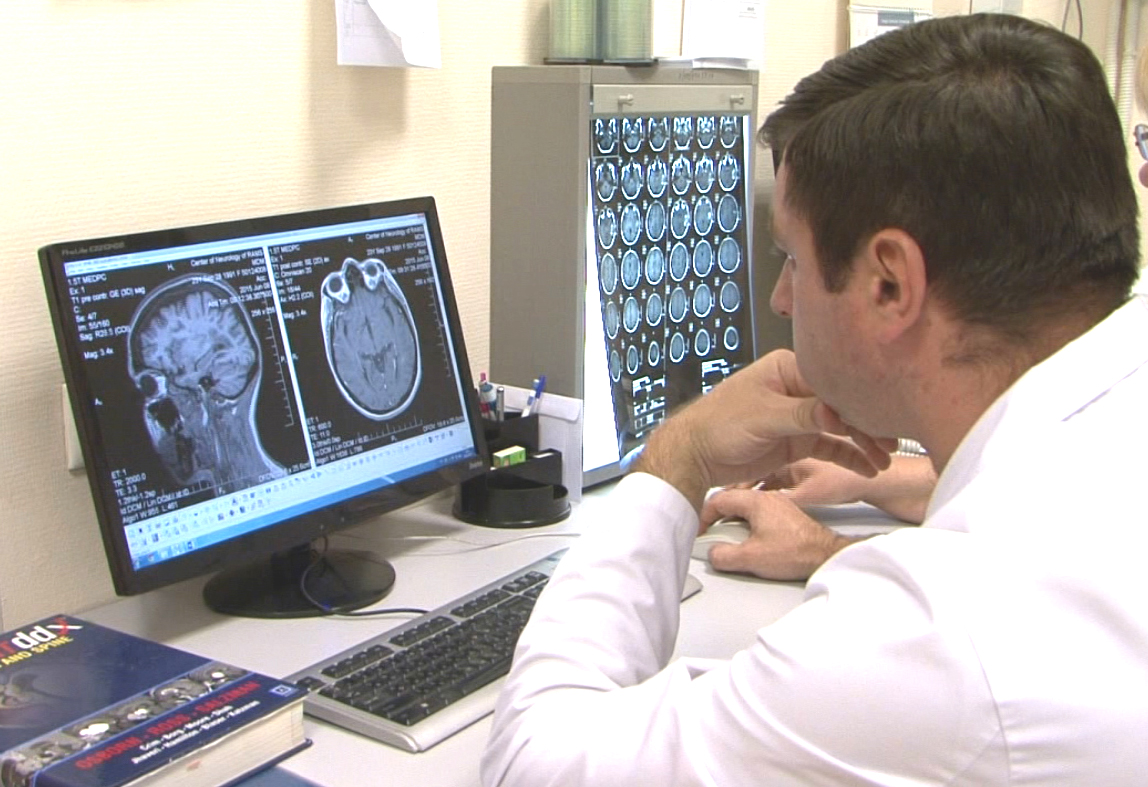
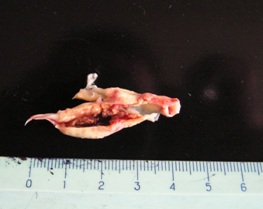 С точки зрения хирургической профилактики инсульта предметом интереса являются атеротромботические и гемодинамические инсульты, обусловленные окклюзионно-стенотическими поражениями сосудов, кровоснабжающих головной мозг. Чаще всего эти поражения формируются в бифуркации общей сонной артерии (ОСА) с переходом на проксимальный сегмент внутренней сонной артерии (ВСА). Редукция кровотока в головном мозге может быть спровоцирована как гемодинамической значимостью атеросклеротической бляшки (АСБ) водноименной ВСА, так и её эмбологенностью. Под термином эмбологенноопасна или «нестабильная» СБ подразумеваются бляшки с изъязвлением, трещиной или эрозией покрышки, а также с кровоизлияниями или включениями атероматозных масс. Неслучайно наличие в АСБ указанных признаков атерогенности считают предикторами ОНМК независимо от степени стеноза ВСА.
С точки зрения хирургической профилактики инсульта предметом интереса являются атеротромботические и гемодинамические инсульты, обусловленные окклюзионно-стенотическими поражениями сосудов, кровоснабжающих головной мозг. Чаще всего эти поражения формируются в бифуркации общей сонной артерии (ОСА) с переходом на проксимальный сегмент внутренней сонной артерии (ВСА). Редукция кровотока в головном мозге может быть спровоцирована как гемодинамической значимостью атеросклеротической бляшки (АСБ) водноименной ВСА, так и её эмбологенностью. Под термином эмбологенноопасна или «нестабильная» СБ подразумеваются бляшки с изъязвлением, трещиной или эрозией покрышки, а также с кровоизлияниями или включениями атероматозных масс. Неслучайно наличие в АСБ указанных признаков атерогенности считают предикторами ОНМК независимо от степени стеноза ВСА.
 Своевременная диагностика окклюзинно-стенотических поражений брахиоцефальных артерий является залогом успешной профилактики и лечения церебро-васкулярных заболеваний. Несмотря на сложность распознавания сосудистых поражений правильный диагноз можно установить при клиническом обследовании пациента на догоспитальном этапе. Помимо выявления неврологических симптомов дефицита кровоснабжения головного мозга не следует пренебрегать традиционными методами физикального обследования, такими как аускультация, манометрия и др. Типичная точка аускультации бифуркации ОСА – под углом нижней челюсти. Наличие в этой проекции систолического шума является патогномоничным признаком стеноза более 70%. По этому же признаку можно выявить стенозирующие поражения брахиоцефального ствола, подключичных и позвоночных артерий, выполняя аускультацию в надключичной области. Методом непрямой манометрии, измеряя артериальное давление (АД) на обеих руках, можно выявить окклюзионно-стенозирующие поражения подключичных артерий и брахиоцефального ствола. Разница давления между верхними конечностями более 30 мм.рт.ст. может свидетельствовать не только о наличии стенозирующего поражения подключичной артерии (на стороне более низкого показателя АД), но и о развитии синдрома «позвоночно-подключичного обкрадывания», несущего высокий риск развития НМК в вертебробазилярной системе.
Своевременная диагностика окклюзинно-стенотических поражений брахиоцефальных артерий является залогом успешной профилактики и лечения церебро-васкулярных заболеваний. Несмотря на сложность распознавания сосудистых поражений правильный диагноз можно установить при клиническом обследовании пациента на догоспитальном этапе. Помимо выявления неврологических симптомов дефицита кровоснабжения головного мозга не следует пренебрегать традиционными методами физикального обследования, такими как аускультация, манометрия и др. Типичная точка аускультации бифуркации ОСА – под углом нижней челюсти. Наличие в этой проекции систолического шума является патогномоничным признаком стеноза более 70%. По этому же признаку можно выявить стенозирующие поражения брахиоцефального ствола, подключичных и позвоночных артерий, выполняя аускультацию в надключичной области. Методом непрямой манометрии, измеряя артериальное давление (АД) на обеих руках, можно выявить окклюзионно-стенозирующие поражения подключичных артерий и брахиоцефального ствола. Разница давления между верхними конечностями более 30 мм.рт.ст. может свидетельствовать не только о наличии стенозирующего поражения подключичной артерии (на стороне более низкого показателя АД), но и о развитии синдрома «позвоночно-подключичного обкрадывания», несущего высокий риск развития НМК в вертебробазилярной системе.
Предложенная Э. Моницем (EgasMoniz) в 1927 году методика рентгеноконтрастной ангиографии на долгие годы приобрела репутацию единственного и наиболее достоверного метода диагностики окклюзионно-стенозирующихпоражений брахио-цефальных артерий. Вместе с тем, указанная методика не лишена недостатков: использовать ее можно только в стационарных условиях, она дорогостоящая и трудоемкая. Кроме того, используемые в то время рентгеноконтрастные вещества были достаточно гепато- и нефротоксичными. И тем не менее, до конца XX столетия рентгеноконтрастная ангиография безоговорочно считалась «золотым стандартом» в диагностике цереброваскулярных заболеваний.
Новым стимулом в диагностике цереброваскулярных заболеваний послужило внедрение в клиническую практику ультразвуковых (УЗ) методов. Свое развитие УЗ диагностика начала с простейших методов – ультразвуковой допплерографии (УЗДГ). Чувствительность и информативность УЗДГ относительно невелика, но достаточна для выявления гемодинамически значимых стенозов и окклюзий брахиоцефальных артерий. В 1974 году Ф. Барбер (F.Barber) предложил УЗ методику, сочетающую в себе визуализацию сосуда в В-режиме и допплеровскую оценку показателей кровотока, получившее название дуплексное сканирование. Позже была предложена методика триплексного сканирования, сочетающая режим одновременного отображения на экране двухмерного изображения, цветового допплеровского картирования и спектра допплеровских скоростей кровотока. В ряду прочих методов ангионейровизуализации дуплексное и триплексное сканирование обладают рядом неоспоримых преимуществ: они высокоинформативны, неинвазивны, доспутны для освоения широкому кругу клиницистов и в разы дешевле, чем ретгеноконтрастная ангиография, магнитно-резонансная или спирально-компьютерная ангиографии. Другим преимуществом УЗ методов является возможность использовать качественную визуальную оценку структуры атеросклеротической бляшки, что существенным образом повлияло на оценку показаний к хирургическому лечению.
Свое повсеместное распространение хирургические методы лечения цереброваскулярных заболеваний получили с середины XX столетия. «Каротидная эндартерэктомия» (КЭАЭ), впервые выполненная в 1954 году H. Eastcott с соавт., на сегодняшний день является «операцией выбора» в лечении стенозирующих поражений сонных артерий. В странах Западной Европы и США КЭАЭ – одна из наиболее часто выполняемых операций. К примеру, в США ежегодно выполняется более 100 000 операций КЭАЭ. Для сравнения, в России ежегодно выполняется только около 10 000 аналогичных операций.
Каротидная эндартерэктомия
С начала 90-х годов XX столетия было проведено несколько национальных (США) и международных (Европа) мультицентровых исследований, в которых сравнивались результаты хирургического и медикаментозного лечения в репрезентативных группах больных. Преимущества и объективность этих исследований очевидны: единых строгий протокол обследования, случайное распределение больных по группам с использованием «двойного слепого метода», статистически достоверный большой клинический материал.
К 1995 году было завершено два крупнейших исследования по сравнению хирургического и медикаментозного лечения симптомных каротидных стенозов. Это NASCET (North American Symptomatic Carotid Endarterectomy Trial) и ESCT (European Carotid Surgery Trial). Оба исследования показали значительное снижение инсульта и смерти уже в течение 2-х лет после КЭАЭ по сравнению с медикаментозно пролеченными больными. Было установлено, что кумулятивный риск инсульта при консервативном лечении составил 26% в противоположность 9% при хирургическом лечении, то есть абсолютное снижение риска составило 17+3,5% (p<0,001). Преимущества хирургического лечения были настолько очевидны, что в 1995 году в США Комитет по наблюдению и безопасности при «Национальном институте неврологических заболеваний и инсульта» применил «правило прекращения» и объявил о завершении исследований по программе NASCET ввиду явного преимущества операции КЭАЭ. С этого времени КЭАЭ стала считаться золотым стандартом в лечении каротидных стенозов.
В конце XX столетия в лечении каротидных стенозов была внедрена методика каротидной ангиопластики со стентированием (КАС). Стент — это тонкая металлическая конструкция (трубочка), состоящая из проволочных ячеек, расправляющаяся самостоятельно или раздуваемая специальным баллоном. Он вводится в пораженный сосуд и, расширяясь, вжимается в стенки сосуда, увеличивая его просвет. Концепцию расширения пораженных участков сосуда с помощью некоего металлического каркаса предложил CharlesDotter. Разработка метода заняла длительное время; первая операция по этой технологии была произведена только в 1986-м году. И лишь в 1993-м году была доказана эффективность метода стентирования для восстановления проходимости сонной артерии.Эндоваскулярное стентирование у больных со стенозами сонных артерий получило высокую оценку среди сосудистых хирургов благодаря малой инвазивности, относительной простоты и коротких сроков реабилитации больных.
Рентгенэндоваскулярная ангиопластика со стентированием внутренней сонной артерии
Однако, до 2000 года не было проведено ни одного рандомизированного исследования, которое доказало бы эффективность этого метода лечения в сравнении с КЭАЭ. В 2001 году немецкие учёные решили провести такое исследование, чтобы сравнить эффективность эндоваскулярного стентирования сонной артерии и КЭАЭ у больных с высоким риском ишемического инсульта.
В исследовании приняли участие 35 центров из Германии, Австрии и Швейцарии. Ученые ставили целью доказать, что эндоваскулярноестентирование не уступает по эффективности и безопасности КЭАЭ, для чего предполагалось получить по крайней мере 2,5% превосходство эндоваскулярного стентирования. Критериями исключения из исследования служили: внутримозговое кровоизлияние, нелеченная артериальная гипертензия, артериовенозная мальформация, артериальная аневризма, наличие тяжёлого сопутствующего заболевания с ожидаемой выживаемостью менее 2 лет, некоррегируемая коагулопатия и противопоказания к введению контраста. Сосудистыми причинами из-за которых больных не включали в исследование были: полная окклюзия общей сонной артерии (ОСА) или внутренней сонной артерии (ВСА), стеноз вследствие экстравазальной компрессии, рестеноз после КЭАЭ или стентирования; пострадиационный стеноз, стеноз по причине фиброзной дисплазии, флотирующий тромбоз, а также тандемный (интракраниальный) стеноз. Критериями сравнительного анализа служили развитие ишемического инсульта или внутримозгового кровоизлияния на стороне вмешательства, а также смерть от любой причины в течение 30 дней после КАС.
Исследование, получившееназвание SPACE (The SPACE Collaborative Group. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial.Lancet. DOI:10.1016/S0140-6736(06)69122-8), проводилось в течение 5 лет: с марта 2001 года по февраль 2006 года. В исследование были включены 1183 больных со стенозами сонных артерий более 70%: 584 больных были включены в хирургическую группу, им была выполнена КЭАЭ и 599 больных включены в группу, которым выполнено КАС. В результате сравнительно анализа КЭАЭ и КАС не было отмечено значимой разницы между указанными методиками как по частоте нефатальных ишемических инсультов, так и по частоте нефатальных внутримозговых кровоизлияний. Не найдено статистически достоверных различий между эндоваскулярной и хирургической группой по частоте инсультов, приведших к инвалидизации и/или смерти в течение 30 дней после лечения. Таким образом, исследование не подтвердило превосходства КАС перед КЭАЭ по частоте периоперационных осложнений.
Говоря о преимуществах или недостатках КЭАЭ и КАС нельзя не упомянуть об мультцентровом рандомизированном исследовании EVA 3S (Endarterectomy Versus Angioplasty in Patients With Severe Symptomatic Carotid Stenosis). Исследование было выполнено во Франции; в нем приняло участие 527 пациентов с симптомными стенозами сонных артерий, перенесших КАС. Окончательные результаты исследования были опубликованы 18 октября2006 года (EVA-3S:Stentingagaininferiortoendarterectjmy. N. Engl. J. Med., 2006, 355: 1660-1671). Исследование показало достоверные преимущества КЭАЭ: совокупный показатель «летальность + инсульт» в течение 30-дневного периода наблюдений после КЭАЭ составил 3,9%, в то время как после КАС – 9,6%.
Комментируя эти данные M. Henry указывает, что «… в исследованиях NASCET и ACAS представлена самая здоровая категория пациентов с поражением сонных артерий, и было бы некорректным экстраполировать результаты работ на повседневную клиническую практику» («Каротидная ангиопластика и стентирование с защитой мозга: методика, результаты и ограничения» М. Анри, И. Анри, А. Полидор, М. Хагель. Ангиология и сосудистая хирургия. Т.11, №4, 2005). Ряд авторов указывают на то, что причиной «неудовлетворительных» результатов КАС в исследовании EVA-3S явилось включение пациентов, которым КАС было выполнено без использования противоэмболической защиты мозга.
Разработка показаний к КАС и КЭАЭ пролегла межой между эндоваскулярными и сосудистыми хирургами. Единого мнения по этому вопросу нет до сих пор. Ссылаясь на мнения признанных авторитетов в сосудистой и эндоваскулярной хирургии можно следующим образом сформулировать показания к КЭАЭ и КАС.
Каротидная эндартерэктомия показана (А.В. Покровский, 2004):
-
У больных с симптомными стенозами ВСА при всех типах бляшек (гипоэхогенные, гетерогенные и гомогенные), суживающих просвет сосуда на 60% и более. А также при стенозах более 50%, обусловленных изъязвленными бляшками.
-
У больных с асимптомными стенозами от 70% и более при любых типах атеросклеротических бляшек. А также при стенозах от 60% и более, обусловленных изъязвленными бляшками.
Каротидное стентирование показано (M. Henry et al., 2005):
-
Пациентам с симптомными стенозами ВСА > 70% (по критериям NASCET)
-
Пациентам с асимптомными стенозами ВСА >80% и дополнительными сосудистыми факторами риска, такими как:
-
состояние перед аорто-коронарным шунтированием;
-
тяжелые сопутствующие заболевания (ИБС, ХОБЛ, сахарный диабет, почечная недостаточность, неконтролируемая гипертония и др.);
-
недоступная для КЭАЭ локализация (бифуркация ОСА на уровне С3-С2, тандемный стеноз ВСА);
-
рестеноз после КЭАЭ;
-
состояние после лучевой терапии на шее;
-
воспалительные или опухолевые заболевания шеи;
-
парез контрлатерального возвратного нерва.
-
С нашей точки зрения, не все вышеизложенные положения можно принять безоговорочно. К примеру, наличие у пациента почечной или печеночной недостаточности скорее является противопоказанием к КАС из-за токсического воздействия рентгеноконтрастного вещества. Неконтролируемую артериальную гипертензию проще коррегировать в условиях общей анестезии, нежели при нахождении больного в сознании.
В работах ряда авторов демонстрируются сопоставимые результаты КАС и КЭАЭ у больных высокого и низкого хирургического риска, что свидетельствует о безопасном использовании oбеих методик (Weisz G., Iyer S., Vitek J. Et al. Short-term outcomes of carotid stenting in lowand high surgical risk patients//JACC. 2004. Vol.43. P.101A, Arjomand H.,Gordin P.,Bruno N.etal. Outcome of carotid artery stenting in high and low surgical risk patients//Amer.J.Cardiol. 2004. Vol.94. P62E., Henry M.,Henry I.,Polydorou A. et al. Short-term outcomes of carotid stenting under protection in high and lowrisk patients//Circulation. 2004. Vol.110,Suppl 111. P.646).
Запись на приём по многоканальному телефону +7 (495) 374-77-76